这个消息确实引起了关注。简单来说,就是礼来公司(Eli Lilly)将其研发的、曾被视为“革命性”的肝癌药物艾维替尼(Avosentan)的海外商业化权益出售给了中国生物制药(Sino Biopharmaceutical)。
以下是几个关键点:
1. "药物背景":艾维替尼是一种靶向血管内皮生长因子(VEGF)的药物,最初由礼来开发,主要针对放射性肝纤维化和相关的肝功能衰竭。
2. "市场表现":尽管艾维替尼在技术上可能有效,但在临床试验中未能达到预期的主要疗效终点,导致其在欧美市场的商业化前景黯淡,未能获得批准或销售额极低。这使得礼来承受了巨大的商业损失。
3. "交易细节":礼来以"象征性的价格"(据报为1美元)将艾维替尼在除中国以外的全球市场的开发、注册和商业化权益出售给了中国生物制药。作为交换,中国生物制药向礼来支付了一笔"前期费用",并承诺在未来满足特定条件时支付"里程碑款项"。
4. "战略考量":
"对礼来":通过出售这个“烫手山芋”,礼来可以剥离亏损资产,止损并专注于其核心业务和更有潜力的管线,减轻了财务负担。
"对中国生物制药":这被视为中国生物制药
相关内容:
日前,据美国华裔首富黄馨祥投资的生物医药公司Sorrento官网信息显示,公司与艾森医药正式签订了一份具有约束力的合作条款,获得其自主研发的马来酸艾维替尼(Abivertinib,代号:AC0010,以下简称艾维替尼)的独家许可,该许可适用于中国境外所有地区的所有适应症,许可的最终条款将在双方之间达成的最终协议中阐明。
同时,Sorrento方面表示,在签署最终许可协议后,公司希望能与美国FDA会面,讨论艾维替尼的数据和寻求肿瘤适应症批准的途径。
据了解,艾维替尼是浙江杭州艾森医药研究有限公司自主研发的靶向EGFR敏感突变(19del、21L858R)和T790M突变的三代EGFR-TKI,主要用于治疗EGFR T790M突变阳性的非小细胞肺癌(NSCLC)。在我国肺癌患者中,超过40%是EGFR基因突变的非小细胞肺癌(NSCLC)患者,使用一代EGFR-TKI治疗后,超过半数会发生T790M突变并耐药,由此,二代、三代EGFR-TKI相继登场,如二代的阿法替尼和达可替尼、三代的奥希替尼。
根据艾森医药官网显示,2018年,艾维替尼完成中国注册临床研究,并向国家药监局递交新药上市申请,同年8月9日,艾维替尼被纳入新药上市优先审评程序,去年6月,艾维替尼亮相第55届ASCO年会,并公布了其治疗中国EGFR-T790M突变阳性的非小细胞肺癌患者的临床研究结果。
研究数据显示,在接受艾维替尼推荐剂量 (300mg BID)治疗的200多例受试者中,90%患者的靶病灶明确缩小,客观肿瘤缓解率(ORR)为52.2%,疾病控制率(DCR)为88.0%,通过Kaplan-Meier评估中位疾病缓解持续时间(DOR)为7.64个月。安全性数据显示,艾维替尼治疗受试者报告的不良事件主要为1级或2级,没有出现药物相关的5级不良事件,主要不良事件和已批准上市的EGFR-TKI类似。该临床研究结果表明,艾维替尼的疗效明确且安全耐受性良好。
临床数据喜人,且最早递交上市申请,艾维替尼曾被寄予厚望,或成“首个获批上市的国产三代EGFR-TKI”,但截至目前,艾维替尼历经多次发补仍然未上市。而最终拔得头筹的是豪森药业的阿美乐(甲磺酸阿美替尼片),其于今年3月获得国家药监局批准上市,用于“既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗进展,且T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者”的治疗,这也是继奥希替尼(泰瑞沙,AZD9291)后,全球第二个获批上市的三代EGFR-TKI药物。
去年11月,行业内有传艾维替尼上市审批失败的消息,并由此直接导致了公司销售团队的解散,同期,艾森医药确有在官网宣布撤销营销团队的消息,对此,艾森药业给出的官方解释有两个原因:一是出于国家宏观层面的系统性因素。随着国家“4+7”带量采购的深入以及大面积的推广,对中国医药行业产生了深远的影响,尤其对自建商业化团队模式带来了挑战,众多药企普遍开始做出调整。二是由于新药研发“门槛高、投入高、风险大”,尤其对于一家初创型药企来说,已经持续研发投入近10年,资金压力积累较多(据不完全统计,从2014年9月至2018年初完成艾维替尼中国注册临床研究,艾森已经持续投入研发费用数亿元),此次战略调整,旨在更专注于创新药的研发,谋求提升新药研发的核心竞争力,也是为了公司持续发展。

在当时艾森医药相关品牌宣传负责人与医谷记者的电话沟通中,否认了艾维替尼上市失败导致公司销售团队解散的说法,并称艾维替尼审评审批还在进行当中。该负责人还表示,公司整个团队从上到下一直都是以极大的热情和努力在开发艾维替尼,即使中间遇到了不少困难,但依然没有选择放弃,谈到动情之处,该负责人甚至一度哽咽。
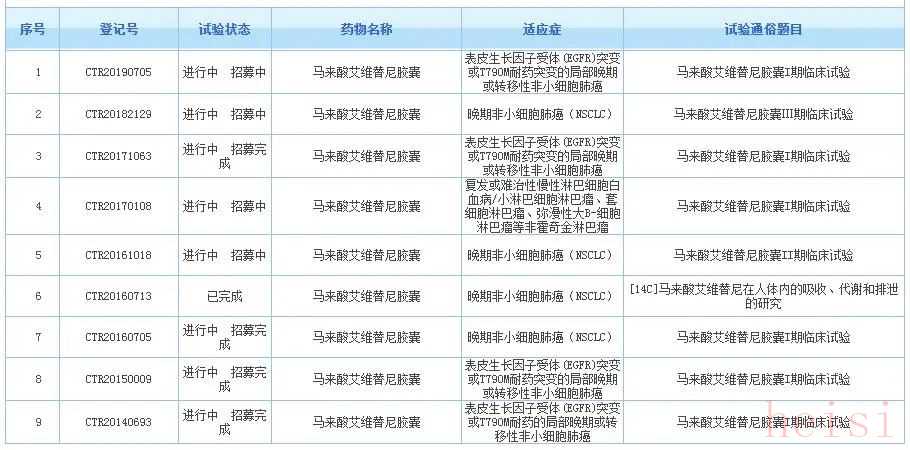
通过药物临床试验登记与信息公示平台查询显示,截止目前,共有9项关于艾维替尼的临床试验登记在列,其中,登记号为CTR20160713的临床试验已完成,其他8项均在进行中或者患者招募中。就在艾森医药加紧艾维替尼的研发之时,国内其他企业在三代EGFR-TKI布局方面也在加快步伐,据医谷记者了解,除了已获批的奥希替尼和阿美替尼,目前,国内有超过10家本土制药企业在研产品进入了临床阶段。
布局进展较快的包括上海艾力斯开发的艾氟替尼,其已于2019年11月29日获得新药上市申请受理,并于12月被纳入优先审评通道,艾氟替尼也有望也或有望成为第二个获批的国产三代EGFR-TKI,根据艾力斯在2019年ESMO大会公布的最新临床I/II期临床数据显示,艾氟替尼ORR(客观缓解率)为76.7%。



